Opis
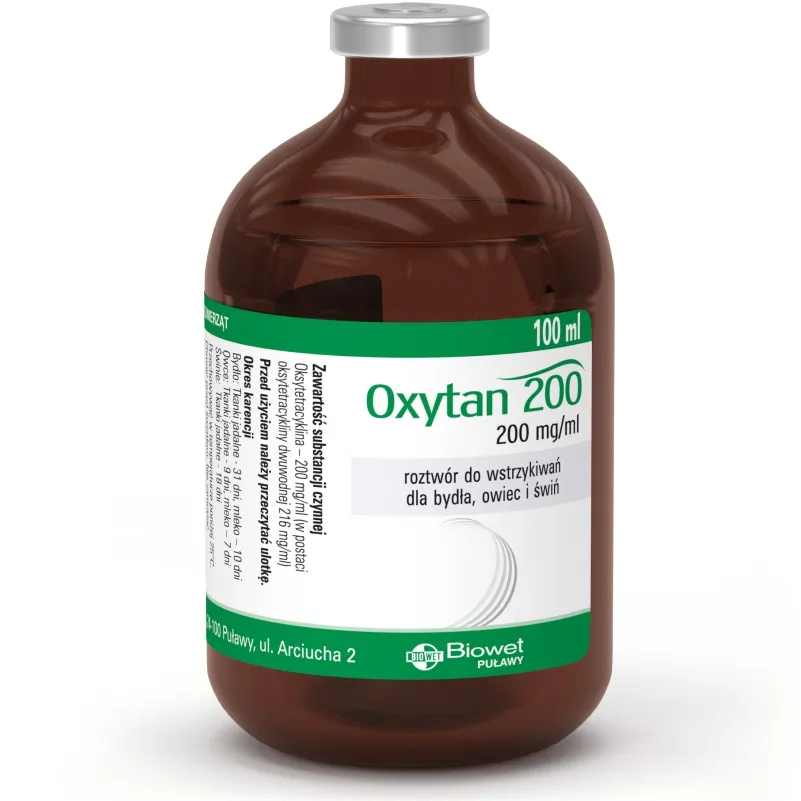
Oxytan 200, 200 mg/ml roztwór do wstrzykiwań dla bydła, owiec i świń
Skład
Każdy ml zawiera:
Substancja czynna:
Oksytetracyklina 200 mg
(co odpowiada 216 mg oksytetracykliny dwuwodnej)
Klarowny roztwór, barwy żółtej do bursztynowej.
Docelowe gatunki zwierząt
Bydło, owca, świnia.
Wskazania lecznicze
Weterynaryjny produkt leczniczy przeznaczony jest do leczenia infekcji wywołanych przez drobnoustroje wrażliwe na działanie oksytetracykliny, a w szczególności w przypadku:
– zanikowego nieżytu nosa wywołanego przez Bordetella bronchiseptica, Mannheimia haemolytica i Pasteurella multocida,
– schorzeń pępka i stawów powodowanych przez Arcanobacterium pyogenes, E. coli lub Staphylococcus aureus,
– zapalenia wymienia wywołanego przez Corynebacterium pyogenes, E. coli, Staphylococcus aureus, Streptococcus agalactiae lub Streptococcus uberis,
– zapalenia macicy wywołanego przez E. coli lub Streptococcus pyogenes,
– pasterelozy i infekcji układu oddechowego wywołanych przez Mannheimia haemolytica i Pasteurella multocida,
– posocznicy spowodowanej przez Salmonella enterica Dublin i Streptococcus pyogenes,
– różycy wywołanej przez Erysipelothrix rhusiopathiae.
Weterynaryjny produkt leczniczy można stosować również do leczenia enzootycznych ronień u owiec.
Przeciwwskazania
Nie stosować w przypadkach nadwrażliwości na tetracykliny lub na dowolną substancję pomocniczą.
Nie stosować u koni, psów i kotów.
Nie stosować u zwierząt z zaburzeniami czynności wątroby i nerek.
Specjalne ostrzeżenia
Specjalne środki ostrożności dotyczące bezpiecznego stosowania u docelowych gatunków zwierząt:
Wrażliwość patogenów na oksytetracyklinę może być zmienna, dlatego stosowanie weterynaryjnego produktu leczniczego powinno być oparte na wynikach badania lekooporności drobnoustrojów izolowanych z danego przypadku. Jeśli nie jest to możliwe, terapię należy prowadzić w oparciu o dostępne lokalne dane epidemiologiczne, z uwzględnieniem oficjalnych przepisów i wytycznych.
Nieprawidłowe stosowanie weterynaryjnego produktu leczniczego może prowadzić do wzrostu częstotliwości występowania bakterii opornych na oksytetracyklinę i zmniejszenia skuteczności leczenia innymi tetracyklinami na skutek oporności krzyżowej.
W przypadku schorzeń przebiegających z upośledzeniem wydalniczej funkcji nerek, okres półtrwania oksytetracykliny jest znacznie przedłużony i przy wielokrotnym podawaniu może ona ulegać kumulacji w organizmie.
Specjalne środki ostrożności dla osób podających weterynaryjny produkt leczniczy zwierzętom:
Osoby o znanej nadwrażliwości na tetracykliny powinny unikać kontaktu z weterynaryjnym produktem leczniczym. Podczas stosowania weterynaryjnego produktu leczniczego należy zachować ostrożność, aby uniknąć przypadkowej samoiniekcji, kontaktu ze skórą i błonami śluzowymi.
Po przypadkowej samoiniekcji należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
W razie dostania się produktu do oka, należy przepłukać je dużą ilością wody i zwrócić się o pomoc lekarską.
Jeśli w wyniku kontaktu z weterynaryjnym produktem leczniczym pojawią się objawy, takie jak wysypka, należy zwrócić się o pomoc lekarską i pokazać ulotkę informacyjną lub opakowanie. Obrzęk twarzy, warg lub oczu, a także trudności w oddychaniu wymagają natychmiastowej pomocy medycznej.
Ciąża:
Nie stosować w okresie ciąży.
Stosowanie oksytetracykliny w okresie formowania kości może powodować zaburzenia ich rozwoju. Podanie oksytetracykliny pod koniec ciąży może spowodować odbarwienie szkliwa zębów.
Laktacja:
Produkt można stosować w okresie laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Tetracykliny chelatują z dwuwartościowymi kationami metali, dlatego nie zaleca się jednoczesnego podawania z preparatami mineralnymi i płynami infuzyjnymi.
Przedawkowanie:
Przekroczenie zalecanych dawek może powodować hepato i nefrotoksyczne działanie leku.
Nie istnieje swoiste antidotum.
W przypadku przedawkowania należy zaprzestać podawania produktu i zastosować leczenie objawowe.
Niezgodności farmaceutyczne:
Ponieważ nie wykonywano badań dotyczących zgodności, weterynaryjnego produktu leczniczego nie wolno mieszać z innymi weterynaryjnymi produktami leczniczymi.
Zdarzenia niepożądane
Bydło, owca, świnia
| Częstość nieznana (nie może być określona na podstawie dostępnych danych): | Bolesność w miejscu iniekcji1, obrzęk w miejscu iniekcji1 |
1 Odczyn w miejscu podania samoistnie ustępuje.
Zgłaszanie zdarzeń niepożądanych jest istotne, ponieważ umożliwia ciągłe monitorowanie bezpieczeństwa stosowania weterynaryjnego produktu leczniczego. W razie zaobserwowania zdarzeń niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, w pierwszej kolejności poinformuj o tym lekarza weterynarii. Można również zgłosić zdarzenia niepożądane do podmiotu odpowiedzialnego przy użyciu danych kontaktowych zamieszczonych w końcowej części tej ulotki lub poprzez krajowy system zgłaszania:
Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
PL-02-222 Warszawa
Tel.: +48 22 49-21-687
Faks: +48 22 49-21-605
Adres e-mail: pw@urpl.gov.pl
Strona internetowa: https://smz.ezdrowie.gov.pl
Dawkowanie dla każdego gatunku, drogi i sposób podania
Podanie domięśniowe.
Weterynaryjny produkt leczniczy należy podać jednokrotnie, głęboko domięśniowo, w dawce 20 mg oksytetracykliny/kg m.c. tj. 1 ml produktu/10 kg m.c.
Maksymalna dawka produktu podana w jedno miejsce wynosi:
Bydło: 20 ml
Świnie: 10 ml
Owce: 5 ml
Prosięta:
1 – dniowe 0,2 ml
7 – dniowe 0,3 ml
14 – dniowe 0,4 ml
21 – dniowe 0,5 ml
powyżej 21 dni 1,0 ml/10 kg m.c.
Zalecenia dla prawidłowego podania
Aby zapewnić prawidłowe dawkowanie, należy jak najdokładniej określić masę ciała zwierzęcia. Należy przestrzegać zasad ogólnej aseptyki podczas stosowania produktu. Weterynaryjnego produktu leczniczego nie należy rozcieńczać przed podaniem.
Okresy karencji
Bydło:
Tkanki jadalne – 31 dni
Mleko – 10 dni
Owce:
Tkanki jadalne – 9 dni
Mleko – 7 dni
Świnie:
Tkanki jadalne – 18 dni
Specjalne środki ostrożności podczas przechowywania
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Przechowywać w temperaturze poniżej 25ºC. Chronić przed światłem. Nie zamrażać.
Nie używać tego weterynaryjnego produktu leczniczego po upływie terminu ważności podanego na etykiecie i pudełku po oznaczeniu „Exp.”. Termin ważności oznacza ostatni dzień danego miesiąca.
Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 28 dni.
Specjalne środki ostrożności dotyczące usuwania
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
Należy skorzystać z krajowego systemu odbioru odpadów w celu usunięcia niewykorzystanego weterynaryjnego produktu leczniczego lub materiałów odpadowych pochodzących z jego zastosowania w sposób zgodny z obowiązującymi przepisami oraz właściwymi krajowymi systemami odbioru odpadów. Pomoże to chronić środowisko.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii.
Szczegółowe informacje dotyczące powyższego weterynaryjnego produktu leczniczego są dostępne w unijnej bazie danych produktów (https://medicines.health.europa.eu/veterinary).
Wydawany na receptę weterynaryjną.
Wielkość opakowania: 100 ml
Dane kontaktowe
Podmiot odpowiedzialny oraz wytwórca odpowiedzialny za zwolnienie serii:
Biowet Puławy Sp. z o.o.
Henryka Arciucha 2
24-100 Puławy
Polska
Tel/fax: + 48 (81) 886 33 53, tel.: + 48 (81) 888 91 00
e-mail: sekretariat@biowet.pl
Dane kontaktowe do zgłaszania podejrzeń zdarzeń niepożądanych:
Biowet Puławy Sp. z o.o.
Henryka Arciucha 2
24-100 Puławy
Polska
Tel: + 48 (81) 888 91 33, tel.: 509 750 444
e-mail: biowet@biowet.pl
Numer pozwolenia: 2499/15
CHWPL: 2025-04-02